Multimodale Analyse von Mausmodellen assoziiert mit GGlutamattransporterdefekten/Anionenkanaldefekten
CSD, eine Welle von synchronen neuronalen Depolarisationen, die sich langsam über den Kortex ausbreitet, ist das Korrelat der Migräneaura. Wir haben verschiedene In-vitro– und In-vivo-Techniken zur Untersuchung der Pathophysiologie der CSD etabliert, die dazu dienten, einen neuen Mechanismus für CSD in einem Scn1a-Mausmodell für hemiplegische Migräne aufzuklären.
Genetische Varianten in SLC1A3, das für den exzitatorischen Aminosäuretransporter 1 (EAAT1) kodiert, wurden bei mehreren neurologischen Erkrankungen, z. B. bei der episodischen Ataxie Typ 6, nachgewiesen. Die Variante p.(Pro290Arg) ist mit einem komplexen klinischen Phänotyp verbunden, der episodische Ataxie, epileptische Anfälle und hemiplegische Migräne umfasst. Die funktionelle Charakterisierung mit Hilfe heterologer In-vitro-Expressionssysteme ergab einen Funktionsverlust beim Glutamattransport, aber einen Funktionsgewinn bei den Anionenströmen. In diesem Projekt wollen wir verstehen, wie eine veränderte Glutamat- und Anionenhomöostase zur Pathophysiologie des oben beschriebenen Phänotyps beiträgt, indem wir eine P290R Knock-in-Maus verwenden.
Im Rahmen dieses Teilprojekts werden wir
- elektrophysiologische Experimente in vitro und Video-EEG-Aufzeichnungen durchführen, um den auftretenden Anfallsphänotyp zu charakterisieren
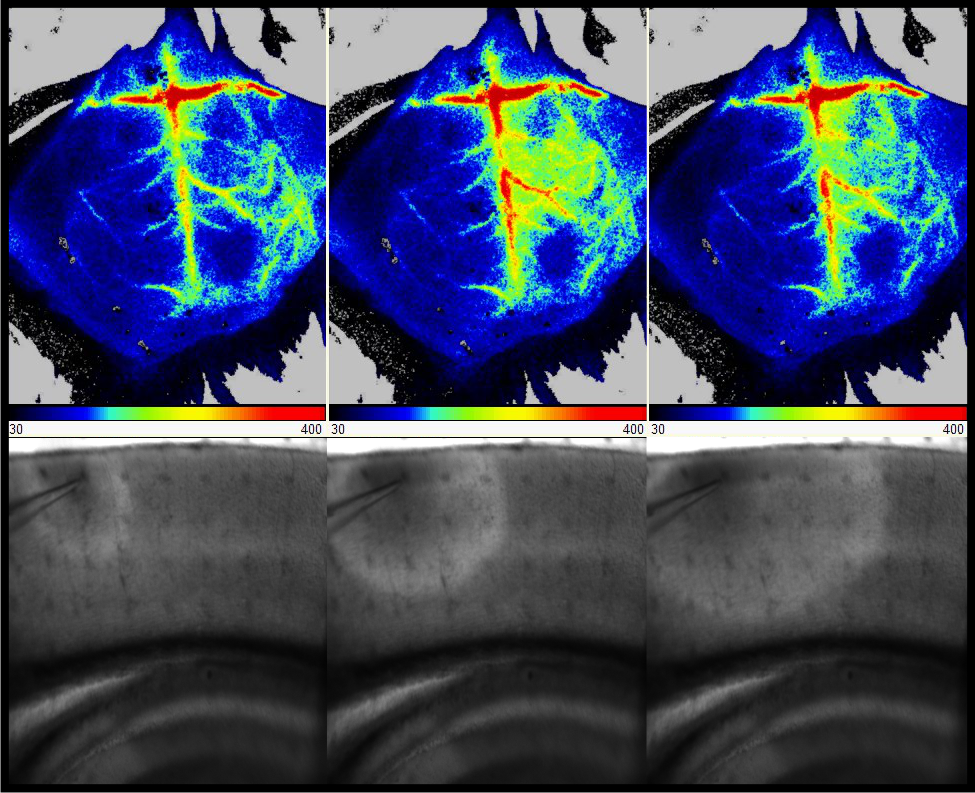
- die Pathophysiologie der CSD durch nicht-invasive CSD-Messungen in vivo untersuchen und die neurovaskuläre Kopplung nach CSD als Mechanismus für Hemiplegie untersuchen
- neue Behandlungsstrategien mit Hilfe von allelspezifischen Antisense-Oligonukleotiden entwickeln und deren Wirkung in unserem Mausmodell in vitro und in vivo untersuchen.
Unsere Arbeit wird neue Einblicke in die Pathophysiologie dieser Krankheit liefern und eine neue therapeutische Option für den verheerenden Phänotyp bieten.